کلرید آلومینیوم
(تغییر مسیر از کلرید آلومینیوم )
| کلرید آلومینیوم (III). |
  |
| شناسایی |
| نام IUPAC |
تری کلروآلومان |
| مترادف ها |
تری کلور آلومینیوم |
| N o CAS |
7446-70-0 |
| ECHA _ بدون |
100.028.371 |
| بدون _ CE |
231-208-1 |
| RTECS _ نه |
BD0525000 |
| کد ATC |
D10 AX01 |
| PubChem |
24012 |
| لبخند می زند |
[Afficher]
|
| InChI |
[Afficher]
|
| ظاهر |
جامد زرد کم رنگ |
| خواص شیمیایی |
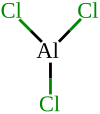
| فرمول |
Al Cl 3 [ایزومرها] |
| جرم مولی 1 |
0006 ± 133341 گرم در مول
Al 20.23٪، Cl 79.76٪، |
| مشخصات فیزیکی |
| T° همجوشی |
190 درجه سانتیگراد [ مراجعه کنید. دلخواه] |
| جوش دمای |
182.7 درجه سانتی گراد در 752 میلی متر جیوه (تععید) 2 |
| انحلال پذیری |
در آب :
439 گرم در لیتر -1 ( 0 درجه سانتیگراد )،
449 گرم در لیتر -1 ( 10 درجه سانتیگراد )،
458 گرم در لیتر -1 ( 20 درجه سانتیگراد )
466 گرم در لیتر -1 ( 30 درجه سانتیگراد )
473 گرم در لیتر -1 ( 40 درجه سانتیگراد )
481 گرم در لیتر -1 ( 60 درجه سانتیگراد )
486 گرم در لیتر -1 ( 80 درجه سانتیگراد )
490 گرم در لیتر -1 ( 100 درجه سانتیگراد ).
اتانول : 1000 گرم در لیتر -1 ( 12.5 درجه سانتیگراد ).
کلروفرم : 0.7 گرم در لیتر -1 ( 20 درجه سانتیگراد ).
CCl 4 : محلول.
اتر : محلول [ رجوع دلخواه] |
| جرم حجمی |
2.44 تا 2.48 g/cm 3 2 |
| نقطه بحرانی |
26.3bar ، 346.85 درجه سانتیگراد 3 |
| کریستالوگرافی |
| سیستم کریستالی |
مونوکلینیک |
| شبکه Bravais |
mC |
| نماد دو پیرسون |
متر سی 16  4 4 |
| کلاس کریستال یا گروه فضایی |
C2/m ( n o 12) 4 |
| گزارش ساختاری |
D0 15 4 |
| موارد احتیاط |
| SGH 5 |

خطر H314
[+]
|
| NFPA 704 |
|
|
| حمل و نقل 2 |
|
|
| اکوتوکسیکولوژی |
| DL 50 |
3450 میلی گرم کیلوگرم در 1 [ مراجعه کنید. دلخواه] |
|
| واحدهای SI و CNTP ، مگر اینکه طور دیگری مشخص شده باشد. |
اصلاح کننده  |
آلومینیوم کلرید (AlCl 3 نیز نامیده می شود ) که تری کلرید آلومینیوم یا کلرید آلومینیوم (III) ، نمکی از آلومینیوم و کلر است. شکل بی آب ساختار خاصی دارد: اگرچه هالید یک فلز بسیار الکترومثبت است ، پیوندهای شیمیایی عمدتاً کووالانسی هستند و یونی آنطور که انتظار می رود نیستند. این نتیجه خاصی دارد که AlCl 3 دمای ذوب و تصعید پایینی دارد ( 178 درجه سانتیگراد برای دومی)، و در حالت مایع ، هدایت می کند را ضعیف ، الکتریسیته برخلاف هالیدهای یونی مانند کلرید سدیم . این ترکیب در حالت جامد به صورت یک شبکه هگزا هماهنگ وجود دارد. و ذوب می شود یک دایمر چهار هماهنگی به نام Al 2 Cl 6 تشکیل می دهد که می تواند تبخیر شود، اما در دمای بالاتر تجزیه می شود و گونه AlCl 3 مشابه BF 3 را تشکیل می دهد.
کلرید آلومینیوم بسیار رقیق است و در تماس با آب تحت اثر هیدراتاسیون می تواند منفجر شود . در تا حدی هیدرولیز مجاورت آب می شود و کلرید هیدروژن ( اسید هیدروکلریک ) را تشکیل می دهد. در محلول آبی ، AlCl 3 به طور کامل یونیزه می شود و محلول به خوبی جریان الکتریکی را هدایت می کند . این محلول اسیدی است . به روشی ساده، کاتیون تولید شده از هیدرولیز کلرید آلومینیوم نوشته شده است:
- [ ال ( اچ 2 O ) 6 ] 3 + + اچ 2 O ↽ – – ⇀ [ ال ( اچ 2 O ) 5 اوه ] 2 + + اچ 3 O +
![{\displaystyle {\ce {[Al(H2O)6]^3+ + H2O <=> [Al (H2O )5OH]^2+ + H3O+}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ca99634e7b52aac56a62d879a5eccde92f41ea87) .
.
AlCl 3 احتمالاً اسیدهای لوئیس است متداول ترین و در میان قوی ترین . این ترکیب کاربردهای بسیار زیادی در صنایع شیمیایی دارد ، به ویژه به عنوان یک کاتالیزور برای واکنش های فریدل کرافت ، هم آلکیلاسیون و هم آسیلاسیون . همچنین برای پلیمریزاسیون یا ایزومریزاسیون واکنش های ترکیبات آلی استفاده می شود .
همچنین کلرید آلومینیوم (I) (AlCl) وجود دارد، اما بسیار ناپایدار است و فقط در حالت گازی شناخته می شود .
خواص فیزیکی و شیمیایی کلرید آلومینیوم
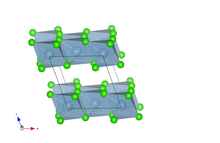
در حالت جامد، کلرید آلومینیوم به دنبال ساختار معمولی YCl 3 متبلور میشود و یونهای Al 3+ یک شبکه مکعبی رو به مرکز را تشکیل میدهند .
کلرید آلومینیوم یک اسید لوئیس قوی است که می تواند در واکنش های اسید-باز لوئیس با بازهای لوئیس حتی ضعیف مانند بنزوفنون یا مزیتلن واکنش نشان دهد . در حضور یک یون کلرید ، واکنش نشان می دهد و AlCl4- را تشکیل می دهد .
جزئی هیدرولیز در حضور آب باعث تشکیل کلرید هیدروژن و/یا اسید کلریدریک می شود . محلول های آبی کلرید آلومینیوم رفتاری مشابه با محلول های نمک های دیگر حاوی Al 3+ یون های هیدراته دارند. به عنوان مثال، همراه با مقدار مناسب سودا ، یک رسوب ژلاتینی از هیدروکسید آلومینیوم را تشکیل می دهد :
- AlCl 3 (aq) + 3 NaOH (aq) → Al(OH) 3 (s) + 3 NaCl (aq) .
ساختار کریستالی کلرید آلومینیوم
در حالت جامد، کلرید آلومینیوم متبلور در ساختار مونوکلینیک نوع RhCl 3 ، با گروه فضایی C 2/m 6 می شود . آن پارامترهای شبکه Å a = 5.914 ، b = 10.234 Å و c = 6.148 Å با β = 108.25 درجه است. در مش، آلومینیوم موقعیت Wyckoff 4g ( y = 0.166) را اشغال می کند و موقعیت های 4i ( x = 0.215 و z = 0.226) و 8j ( x = 0.252، y = 0.321، z = 0.225) را کلر می کند. ساختار به دست آمده یک ساختار ورق در صفحه (a, c) است که آلومینیوم در مرکز هشت وجهی آلومینیومی قرار می گیرد و یک ساختار لانه زنبوری در صفحه (a, b).
AlCl 3 ، ساختار ورقه ای، آلومینیوم در اینجا در مرکز چند وجهی هماهنگی که توسط یون های کلرید تشکیل شده است، قرار دارد.
AlCl 3 ، ساختار لانه زنبوری، آلومینیوم در اینجا در مرکز چند وجهی هماهنگی که توسط یون های کلرید تشکیل شده است، قرار دارد.
آماده سازی کلرید آلومینیوم
کلرید آلومینیوم به صورت صنعتی از واکنش مستقیم آلومینیوم و کلر تولید می شود :
- 2 Al + 3 Cl 2 → 2 AlCl 3
یا از آلومینیوم و اسید هیدروکلریک :
- 2 Al + 6 HCl → 2 AlCl 3 + 3 H 2 .
این واکنش گرمازا است و نیاز به خنک کردن فلاسک در حمام آب سرد دارد.
لایه غیرفعال سازی آلومینیوم (متشکل از اکسید آلومینیوم (Al 2 O 3 )) باعث می شود که در ابتدا خیلی واکنش پذیر نباشد، اما زمانی که این لایه حذف شد، آلومینیوم واکنش پذیرتر می شود. بنابراین توصیه می شود که آلومینیوم را در اسید کلریدریک غلیظ 23 درصد ترشی کنید و پس از شروع واکنش، اسید را با حجم آن در آب مقطر رقیق کنید (تا غلظت آن بر دو تقسیم شود) تا حرارت موضعی (روی سطح) محدود شود. آلومینیوم) که ممکن است (با وجود خنک شدن کلی محیط واکنش از طریق حمام آب سرد) محلول اسید کلریدریک را با انتشار گاز کلرید هیدروژن گاز زدایی کند.
بالون همچنین باید باز شود زیرا همانطور که در بالا ذکر شد، واکنش دی هیدروژن آزاد می کند، اما توصیه می شود برای محدود کردن انتشار کلرید هیدروژن (بخار آب متراکم شده روی سطح قیف، قسمت بزرگی از هیدروژن کلرید گازی آزاد شده در اثر حرارت دادن اسید کلریدریک در قطرات آب حل می شود تا اسید کلریدریک را اصلاح کند که در محیط واکنش بازمی گردد و در عین حال اجازه می دهد دی هیدروژن (و کمی کلرید هیدروژن) از سوراخ قیف خارج شود.
استفاده کلرید آلومینیوم
- کاربرد اصلی آلومینیوم کلرید در ساخت ترکیباتی با واکنش فریدل کرافت است که کاتالیزور آن است ، به عنوان مثال ساخت آنتراکینون (برای صنعت رنگ ) از بنزن و فسژن . در طی واکنش فریدل کرافت، یک آسیل کلرید یا یک آلکیل هالید با ترکیب معطر زیر واکنش می دهد :

با مشتقات بنزن ، محصول اصلی واکنش ایزومر پارا است. از آنجایی که واکنش آلکیلاسیون مشکلات زیادی را ایجاد می کند، نسبت به واکنش اسیلاسیون کاربرد کمتری دارد. در هر دو مورد، کلرید آلومینیوم (یا تجهیزات مورد استفاده) نباید کاملاً بی آب باشد، برای اجرای واکنش ردپایی از رطوبت لازم است. یکی از مشکلات واکنش Friedel-Crafts این است که کاتالیزور (کلرید آلومینیوم) باید در یک مقدار استوکیومتری وجود داشته باشد تا واکنش کامل شود زیرا یک کمپلکس پایدار را بسیار دشوار می کند با محصول تشکیل می دهد. این ویژگی بازیافت ، به طوری که آنها باید پس از استفاده از بین بروند، که مقدار زیادی پساب خورنده تولید می کند. به همین دلیل، شیمیدانان در حال بررسی امکان استفاده از کاتالیزورهای خنثی تر از نظر محیطی مانند ایتربیوم (III) تری فلورومتان سولفونات یا دیسپروزیم تری فلورومتان سولفونات هستند. (III) که گران تر هستند اما قابل بازیافت هستند.
- کلرید آلومینیوم همچنین میتواند در واکنشها برای وارد کردن توابع آلدهید در حلقههای معطر استفاده شود ، به عنوان مثال پس از واکنش گاترمن-کخ که از مونوکسید کربن ، کلرید هیدروژن و کلرید مس (I) به عنوان کاتالیزور کمکی استفاده میکند:
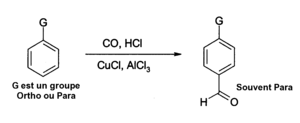
- کلرید آلومینیوم کاربردهای بسیار دیگری در شیمی آلی دارد :
- AlCl 3 در پلیمریزاسیون یا ایزومریزاسیون واکنش های ترکیبات آلی استفاده می شود . کاربردهای مهم عبارتند از ساخت اتیل بنزن (که برای ساخت استایرن و سپس پلی استایرن استفاده می شود ) و تولید دودسیل بنزن (که برای ساخت مواد شوینده کلرید آلومینیوم استفاده می شود ).
- AlCl3 کاتالیز به ویژه واکنش Diels-Alder را می کند .
- – buten AlCl3 همچنین افزودن 3 -2-one را به کارون کاتالیز می کند :

- در نهایت، این یک منعقد کننده معدنی است که به طور گسترده توسط فرآیندهای خاص تصفیه آب ، به شکل پلی کلرید آلومینیوم (PAC) 7 . همچنین در این زمینه می تواند فلوراید اضافی موجود در آب را از بین ببرد. برای آلوده نشدن آب آشامیدنی با آلومینیوم و برای انعقاد خوب، pH فرآیند انعقاد و همچنین دوزهای مورد استفاده باید به خوبی کنترل شود 7 . هم زدن آب و همچنین سیستم فیلتراسیون (که باید آگلومراهای آلومینیومی را حذف کند) کافی باشد 7 . کیتوزان و بنتونیت افزودنی های مفیدی هستند 7 .

Pac Products persian
امنیت کلرید آلومینیوم
AlCl 3 می تواند باعث انفجار شود در صورت تماس با پایه یا آب . این یک معرف است که کلرید آلومینیوم باید با احتیاط و با استفاده از دستکش و عینک ایمنی مورد استفاده قرار گیرد. آن را باید در زیر یک هود بخور داد. هنگامی که در هوای مرطوب استفاده می شود، کلرید آلومینیوم به سرعت رطوبت را جذب می کند تا بسیار اسیدی شود و به سرعت به تعداد زیادی از مواد از جمله فولاد ضد زنگ و لاستیک حمله می کند.
هگزا هیدرات کلرید آلومینیوم
فرمول ساختاری: AlCl 3 (H 2 O) 6 .
این محصول، پایدار، برای پوست تهاجمی نیست. حتی در ترکیبات پوستی در درماتولوژی وارد می شود (به هایپرهیدروز مراجعه کنید ).
این رایج ترین شکل تهویه کلرید آلومینیوم است که نمک بی آب مورد نظر نیست. آن شماره CAS 7784-13-6 است. جرم مولی آن 241.432 گرم بر مول است.
مترادف های اصلی:
- نام انگلیسی: آلومینیوم تری کلرید هگزا هیدرات؛
- نام انگلیسی: هگزا هیدرات تری کلرید آلومینیوم.






![{\displaystyle {\ce {[Al(H2O)6]^3+ + H2O <=> [Al (H2O )5OH]^2+ + H3O+}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ca99634e7b52aac56a62d879a5eccde92f41ea87)