cristal _ una sustancia sólida que tiene sus propios componentes básicos – p.e. Átomos, iones o moléculas, dispuestos regularmente en una estructura cristalina. Los materiales cristalinos populares son la sal de mesa, el azúcar, los minerales, el hielo y los minerales. Debido a la disposición regular de los átomos o moléculas, los cristales no tienen simetría continua, sino simetrías discretas. Se habla de orden de largo alcance o simetría transitiva.
La cristalografía es la ciencia de las propiedades y formas de los cristales. La mineralogía y la metalurgia están estrechamente relacionadas.
Tabla de contenido
- 1 Una definición más precisa, distinción
- 2 palabras de
- 3 Estructura y clasificación de cristales periódicos.
- 4 cristalización
- 5 propiedades
- 5.1 Errores de red
- 6 números y ejemplos
- 6.1 Monocristal y cristal
- 6.2 Metales
- 6.3 Aplicaciones técnicas
- 6.4 Cristales orgánicos
- 6.5 coloides
- 7 literatura
- 8 enlaces web
- 9 notas
- 10 pruebas individuales
Una definición más precisa, diferenciación.
Un cristal es un cuerpo homogéneo porque es física y materialmente homogéneo. Pero muchas propiedades físicas dependen de la orientación en el espacio. h. Es un cristal anisotrópico. [1]
Fueron definidos, antes de 1992, como cristales periódicos: en este sentido, un cristal está formado por unidades estructurales periódicas tridimensionales que se mantienen constantes. [2] Esta unidad estructural se llama celda unitaria o protocélula.
Desde 1992, según la Unión Internacional de Cristalografía IUCr [3], un cristal se define por su orden de difracción discreto (cuando se ilumina con rayos X). Tiene por tanto un orden de largo alcance, pero no necesariamente periódico. Esta definición se aplicó con el descubrimiento en 1984 de los pseudocristales, que forman un subconjunto de cristales no periódicos. Sin embargo, los cristales periódicos constituyen, con diferencia, el subconjunto más grande de cristales.

La distinción se realiza en función de las características del modelo externo.
- Los cristales se formaron sin daño, los llamados idiomórficos (del griego antiguo ἲδιος ìdios “yo” y μορφἠ morphe “forma”) y
- Cristales xenomorfos (del griego antiguo ξένος xénos «externo» y μορφἠ « forma») cuya forma externa está determinada por interfaces externas.
La forma exterior del cristal muestra la estructura cristalina correspondiente. Entonces z. B- Cristales de cloruro de sodio (sal común, halita mineral) que se cultivaron sin tratamiento en forma de cubos. Incluso en el caso de cristales amorfos suele haber una cierta deformación en la naturaleza, es decir, la longitud de los bordes (no los ángulos) puede desviarse significativamente de la forma ideal (ley de invariancia angular ) .
La forma externa de un cristal está determinada por las características independientes del hábito cristalino y del hábito cristalino. Los planos de la red y las caras del cristal se describen mediante índices de Miller.
Los tipos de cristales también se pueden distinguir por la forma en que están conectados sus bloques de construcción (por ejemplo, cristales iónicos).
Dado que la característica distintiva de los cristales es su disposición regular en las tres direcciones espaciales, también es posible imaginar objetos cuyos componentes se repitan sólo en una o dos direcciones espaciales. Entonces podemos hablar de cristales unidimensionales y bidimensionales. En la naturaleza existen proteínas de membrana que se posicionan como cristales bidimensionales en la membrana biológica. Un ejemplo de esto es la bacteriorrodopsina. [4] En biología estructural, el crecimiento de cristales bidimensionales determina la ubicación atómica de grandes moléculas cristalinas mediante microscopía electrónica de barrido . [5]

Además de los cristales, también hay cosas que no tienen un orden interno de largo alcance y se llaman amorfas. Por ejemplo, el vidrio (también llamado cristal de plomo y otros vasos de cristal).
Si el líquido es anisotrópico y, como resultado, tiene algunas propiedades de un cristal, entonces el cristal es un líquido. [6]
Origen de la palabra
La palabra cristal se deriva de la palabra griega κρύσταλλος kristallos (Zo cold krýos “frío, escarcha, hielo”). Originalmente, Homero se refería al hielo, cualquier cosa parecida al hielo, ligera y luego transparente. Específicamente cristal de roca, pero también se denomina así a las piedras preciosas de colores y al vidrio (por ejemplo, en Estrabón y Claudio Ailianus). [7]
Se descubrió que en la antigua Grecia, durante la minería, probablemente se formaban cristales de cuarzo. Se pensaba que eran hielos que debían formarse a temperaturas tan bajas que ya no podían derretirse. Esta visión prevaleció hasta principios de la Edad Media. En el caso del latín kristalos (también kristalos , especialmente “cristal de montaña”, [8] y kristall lapis [9] el término kristallo con el tiempo pasó al componente alemán antiguo kristall ), cambió . [10] En el siglo XIX también se utilizaba el cristal .
Productos PAC Cloruro de aluminio polipersa (PAC) 
Estructura y clasificación de cristales periódicos.

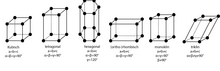


La dirección y longitud de los vectores mediante los cuales se puede mover una estructura cristalina de tal manera que se repitan las posiciones atómicas, [12] describen vectores de traducción o de base. Se representa así la estructura de cada tipo de cristal a través de su sistema de coordenadas, es decir, el sistema axial . [13] Además de la traslación, la estructura cristalina también puede girar alrededor de estos ejes hasta que la estructura girada coincida con la estructura original. Debido a que se debe preservar la simetría traslacional, solo pueden ocurrir simetrías rotacionales que describen una, dos, tres, cuatro o seis repeticiones en una rotación completa (360°). Hablamos de ejes de 1, 2, 3, 4 o 6 tiempos. [14] Hay cristales que, además de los ejes de rotación y traslación, tienen otros elementos de simetría , como superficies especulares y centros de reflexión, así como conexiones entre estas simetrías con reflexiones rotacionales [Nota 1] , reflexiones de deslizamiento [Nota 2 ] y tornillos. [Nota 3] [15]
Las características de simetría se utilizan para clasificar los cristales. [16] El número de posibles combinaciones y pares de elementos de simetría es finito (ver también teoría de grupos). Completo en Tablas internacionales de cristalografía, volumen A. Enumerados en cristales 3D hay 17 grupos de cristales planos en cristales 2D y 230 grupos de cristales espaciales, que son [17] [18]
Si se examina un cristal nuevo, inicialmente se desconoce el grupo espacial. Al describir la apariencia externa de un cristal, sólo se puede asignar a un grupo de 32 grupos de puntos (también llamados clases de cristal). Estos conjuntos de puntos describen las propiedades de simetría macroscópica de los cristales y resumen los grupos espaciales que difieren sólo en la simetría traslacional. La traducción es irrelevante cuando se miran los cristales desde fuera. [19] Debido a que los ángulos entre los planos cristalinos son los mismos para cada tipo de cristal y a menudo son consistentes con la simetría rotacional (por ejemplo, 90 ° para halita con simetría rotacional cuádruple), se utilizan siete sistemas cristalinos para describir la morfología del cristal, en los cuales los posición . Los ejes relativos de distintas longitudes de celda. Dependiendo del sistema cristalino al que pertenece el cristal, el cristal es trigonal, monoclínico, ortogonal, tetragonal, triangular, hexagonal o cúbico. [20]
Agosto Bravos clasificó diferentes posibles redes de traducción. De manera equivalente, estas cuadrículas constan de paralelogramos cuyos vértices representan puntos de la cuadrícula. Para poder describir ciertas simetrías reticulares, permitió no sólo celdas unitarias elementales (con un punto de red por celda), sino también celdas unitarias más grandes ubicadas o centradas en el cuerpo. En la Figura 5 se muestra un ejemplo de una celda unitaria centrada en la cara. Hay 14 redes de Bravais en el espacio 3D. [11]

En el análisis de la estructura cristalina, los patrones de difracción de rayos X se pueden dividir en 11 grupos de puntos centrales simétricos llamados grupos de Laue o clases de Laue. Esto se debe a que los patrones de difracción centralmente simétricos también ocurren en estructuras cristalinas asimétricas, donde los reflejos aparecen como pares de Friedel con la misma intensidad normal. Por lo tanto, los grupos de Laue se pueden obtener agregando un centro de simetría al grupo de puntos del cristal. [21]
La estructura cristalina no es específica de una sustancia, es decir, una sustancia con una composición química específica puede tener diferentes estructuras termodinámicamente estables dependiendo de las condiciones externas (presión, temperatura). Las diferentes estructuras cristalinas de la materia con modificaciones se denominan… La presencia de diferentes cambios se llama polimorfismo. La física de las fases de estos cambios muestra una diferencia desde el punto de vista de la química, cuyo alcance se puede mostrar en los diagramas de fases. En el caso del hierro, los cambios o fases individuales del elemento suelen estar numerados sucesivamente con letras griegas minúsculas (p. ej., α- (ferrita), γ- (austenita), δ-, ε-hierro; ver Fe). – Carta de carbono).
Cristal
Un cristal se forma cuando los átomos o moléculas forman una estructura regular de largo alcance. Ocurre en sistemas de una sustancia, cristalizada en otra fase cristalina, en un vapor o en una masa fundida. Además, se pueden formar cristales a partir de sistemas multicomponentes, es decir, a partir de una solución. Para permitir la cristalización, el estado de los átomos o moléculas no debe estar en equilibrio. Para lo anterior se utilizan vapor y soluciones saturadas. [22]
La velocidad juega un papel en el crecimiento de los cristales. Por ejemplo, en caso de fusión, la temperatura debe descender lentamente por debajo del punto de fusión. Entonces el movimiento térmico de los átomos individuales se vuelve tan pequeño que los enlaces mutuos ya no pueden romperse mediante vibraciones: se forma una red uniforme caracterizada por un orden de largo alcance. Por otra parte, si la temperatura de fusión se reduce demasiado rápido de modo que los átomos no puedan ordenarse periódicamente, se forma un material amorfo, un vidrio que sólo tiene un orden de corto alcance. Debido a su estructura reticular regular, el cristal tiene un contenido libre menor que el vidrio amorfo.
La formación de cristales es un proceso exergónico: aunque la entropía del sistema disminuye (debido al aumento del orden de largo alcance), a temperaturas hasta el punto de fusión se compensa con una disminución de la entalpía debido a la atracción entre partículas. (= entalpía de cristalización).
El punto de partida para la formación de cristales es un núcleo de cristalización que crece a medida que disminuye la temperatura. Si hay muchos núcleos cristalinos o si la cristalización comienza en varios puntos simultáneamente, se forma un policristal. ) crecen juntos durante la cristalización y, en muchos casos, hay dos cristales que tienen la misma estructura y composición, pero difieren en la orientación espacial (gemelos cristalinos).
La recristalización es un cambio en la estructura cristalina debido a cambios en factores externos como las condiciones de presión y temperatura. Aquí el sólido cristalino cambia de forma.
La producción industrial de cristales se llama crecimiento de cristales.
Propiedades
Los cristales minerales no metálicos son más duros pero más quebradizos. Todos los metales suelen solidificarse en forma cristalina en el equilibrio termodinámico.
El comportamiento de la luz en los cristales se describe mediante la óptica de cristales. Sus propiedades y fenómenos importantes son la actividad óptica, la polarización, la refracción y el pleocroísmo. Las estructuras aislantes periódicas, llamadas cristales fotónicos, exhiben nuevas propiedades ópticas.
Algunos cristales, por ejemplo los cristales de cuarzo, tienen propiedades piezoeléctricas. Crean un voltaje eléctrico cuando se deforman y se deforman cuando se les aplica un voltaje eléctrico. [23] Este efecto se crea en los encendedores piezoeléctricos utilizando chispas de encendido. En electrónica, los osciladores piezoeléctricos actúan como generadores de reloj (por ejemplo, en los relojes de cuarzo). Algunos cristales piezoeléctricos, pero no todos, convierten las diferencias de temperatura en separación de cargas. Esta propiedad se llama seguimiento electrostático. [24] Estos cristales se utilizan en detectores de movimiento y sensores de temperatura. Existe un caso especial de materiales paraeléctricos: en los cristales ferroeléctricos, la polarización eléctrica se puede invertir aplicando un voltaje. [25]
Errores de red
Un cristal real contiene defectos de red, es decir, la disposición periódica tridimensional de los átomos está desordenada. Hay errores de puntos, errores de línea, errores de área y errores de tamaño. Los defectos puntuales son los únicos defectos de la red que también ocurren en el equilibrio termodinámico. Un cristal sin defectos de red tiene una entropía mínima y no se puede lograr según la segunda ley de la termodinámica. Mide aproximadamente 10 5 cm -2 cm , y los cristales regulares y policristalinos miden 10 5-10 9. Los monocristales cultivados en laboratorio tienen una densidad de dislocación cm -2 y los cristales muy distorsionados alcanzan 10 14 3-10 -2 . [26] , Los defectos puntuales y de tamaño suelen ser características de las propiedades de los cristales fotónicos, mientras que los defectos lineales (desórdenes) y los defectos superficiales (límites de grano) son características de las propiedades mecánicas.
Números y ejemplos
Monocristal y policristal
Un sólido cristalino suele estar formado por muchos cristales y no por cristales individuales, es decir, por muchos cristales pequeños (cristalitos) separados entre sí por límites de grano. Por ejemplo, los objetos metálicos, alambres, etc. suelen ser policristalinos. Si el cuerpo consta de diferentes tipos de cristales, las interfaces entre ellos se denominan límites de fase.
Rieles


Muchos minerales son capaces de formar una variedad de formas y colores de cristales. Sus formas van desde cristales gruesos e incoloros ( cristal de roca) hasta microcristalinos multicolores (opacos) y, por otro lado, la calcita con una variedad de tipos similares. Los ejemplos más famosos son, por un lado, el cuarzo, que recubre
Los cristales más grandes del mundo fueron descubiertos en la mina de Naica en el año 2000. Están hechos de yeso de Marienglas, miden hasta 14 metros [27] de largo y pesan hasta 50 toneladas.
El diamante es la forma cristalina de carbono más dura del mineral natural. Además, el silicio cristaliza en forma de diamantes.
Aplicaciones técnicas
El silicio es actualmente el material que se utiliza en grandes cantidades como monocristal (cristal único), es decir, en la tecnología de semiconductores. Hoy en día, es común un diámetro de 30 cm para un cristal cilíndrico “extraído” de la masa fundida, un proceso que se remonta a Jan Czukralski alrededor de 1916. El arseniuro de galio (GaAs) también se utiliza como semiconductor y tiene una estructura llamada aleación de zinc.
La nanotecnología se ocupa, entre otras cosas, de los nanocristales.
Pequeños cristales de diamante, corindón y carburo de silicio en suspensión, sueltos o atados, se utilizan como abrasivos, y los diamantes individuales también se pueden utilizar como herramientas de corte.
Los cristales piezoeléctricos pueden ser micrófonos, amplificadores, sensores de fuerza o actuadores.
La preparación se limpia en plantas químicas mediante recristalización.
Sin embargo, la cristalización es indeseable en la producción de vidrio. En la producción de metales, el objetivo suele ser obtener cristales o granos lo más pequeños posible.
Cristales orgánicos
Materiales orgánicos, por ejemplo. para. El azúcar y las proteínas forman cristales, pero estos últimos, salvo en casos excepcionales. En los peroxisomas de las plantas, por ejemplo, se encuentran cristales de catalasa que se pueden observar con un microscopio electrónico. [28] La enzima catalasa es una proteína. La cristalografía de proteínas se ocupa del crecimiento de cristales de proteínas para el análisis estructural.
coloides
Los coloides suelen formar cristales semicristalinos porque los componentes básicos no son todos iguales, los propios componentes básicos suelen ser anisotrópicos y porque coexisten enlaces fuertes y débiles entre átomos y grupos de átomos. Por otro lado, las suspensiones de bolas sólidas monodispersas pueden formar cristales porque los componentes básicos son idénticos y homogéneos.
